超多重 qPCR 新突破,阅尔基因创新技术在 Nucleic Acids Research 重磅发表
体外分子诊断技术常见于感染、肿瘤、遗传病等需要明确病因的场景。其中荧光定量PCR(qPCR)因低成本、短耗时、装机量大的特点非常适合快速转化和临床推广,然而大部分qPCR仪只能提供4~6个检测通道,与质谱、NGS等相比单次反应覆盖的靶标范围有所欠缺。超多重qPCR方法的技术革新弥补了这方面的不足,从而大为丰富qPCR的应用场景。以病原检测为例,超多重联检既能满足患者扩大排查范围的需要,也可以为初检阴性或经验性治疗无效的患者提供及时、全面的复测。
在多重qPCR方面,阅尔基因进行了大量探索工作,比如基于多色编码组合的 Color-Mix策略、可用于RNA病毒分型的caPCR系统等等。近日,阅尔基因联合复旦大学附属中山医院、同济大学附属肺科医院,在经典的国际权威期刊《Nucleic Acids Research》(IF=16.6)发表了CCMA(Color Cycle Multiplex Amplification)超多重扩增技术¹,利用同一靶标多个扩增子之间可控的Ct延迟设计多色编码组合,单管qPCR反应即可鉴定21种常见病原体。理论上,仅需4个荧光通道可实现136重检测。针对全血、痰液、肺泡灌洗液等复杂样本的临床验证结果显示,CCMA的灵敏度和特异性分别为89%和100%,有潜力作为临床快速筛查病原感染的新型诊断工具。
超多重qPCR技术有诸多实现思路,但需要解决的核心问题是一致的。首先,有限的荧光通道数量与数倍甚至数十倍的通量需求相悖,如何提高判读条件的维度十分关键。其次,体系中过多的引物探针种类可能带来不稳定扩增现象,比如非特异性扩增、引物二聚体、不均一的扩增效率等等。接下来,我们从这两方面来看该领域现有方案的设计思路以及CCMA的创新之处。
信号解耦
从qPCR仪读取到的扩增曲线、溶解曲线、终点荧光值等信息,需要进行转换和计算并对应到唯一的检测结果。主流技术大致可分为以下三类:
第一类技术利用微流控等工程手段将qPCR反应分配到不同腔室或模块以增加多重性,也是最为直接的实现方式,代表性产品包括生物梅里埃的FirmArray 、凯杰的QiaStat-Dx以及赛沛的GeneXpert。这类方法的优点在于将样本前处理和后续数据分析集成到一套POCT设备中,然而设备耗材往往价格昂贵,并且出于有限的样本浓度以及制造成本考虑,重数通常控制在10-20之间。
第二类技术使用不同荧光编码组合来区分多个靶标,最大通量与荧光通道呈指数增长关系。比如一台4通道仪器可以做到单管15重(2ⁿ-1),阅尔基因开发的Color-Mix²技术、以及部分数字PCR平台均支持这种设计。单纯的多色编码难以应对多靶标共存的情况,因此ddPCR需要精确控制探针浓度(荧光强度)以增加判定维度³。Park等人提出的LiNC PCR技术则完全依靠荧光强度进行区分,这是通过在多重连接探针两端设计数量不等的荧光探针结合位点来实现的⁴。更多的探针结合位赋予了LiNC PCR更强的多重能力,但也降低了PCR效率,并且系统性灵敏度受限于初始的连接反应效率。
第三类技术依赖于高分辨率溶解曲线(HRM),并且能够与不同荧光标记的探针形成数量可观的判读组合,检测通量在20~60重左右。市场上已经有一些基于HRM的诊断试剂产品。这类方法流程方便,但实验操作条件要求较高,如单个碱基突变时熔解温度差异很小,此时对qPCR仪的温度分辨率和温度均一性就有很高的要求。同时该方法对变异的容忍度较低,探针结合区域的错配碱基可能导致溶解曲线大幅偏移⁵。此外,随着探针数目增加,较高的背景信号也限制了其最低检测下限。这些问题的存在限制了HRM的临床推广。
另外还有一些免扩增方法,比如基于编码微球的流式荧光技术,基于磁共振的T2MR技术,它们在通量上具有显著优势,但另一方面也高度依赖于特殊仪器和耗材。
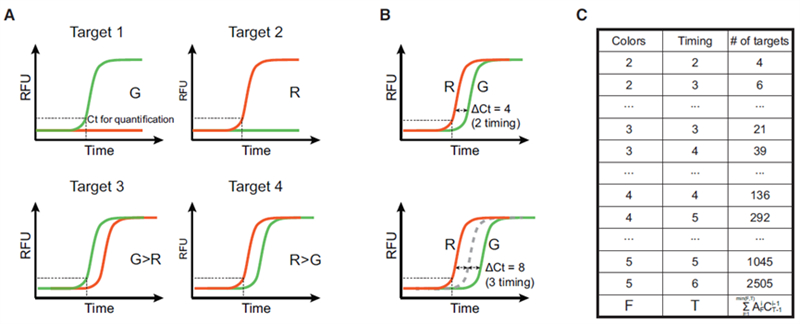
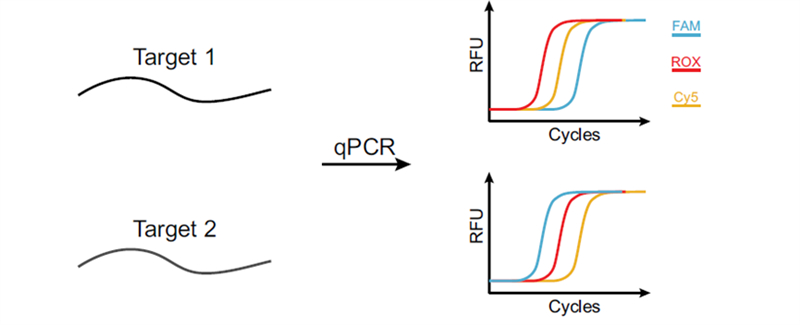
图1 CCM的设计原理
CCMA技术是首个仅需借助常规qPCR仪即可实现超指数级多重且可定量检测的技术。其核心原理是:为每个靶标设计多个扩增子,在不同荧光通道的扩增曲线之间引入可编程的Ct值延迟,进而根据荧光出现顺序识别不同靶标(图 1)。比如2个荧光通道(G和R)最多可以鉴别4个靶标。荧光通道数(F)和可控Ct延迟数(T)决定了CCMA的多重性:

可控的Ct延迟是CCMA工作的基础,这一特性是通过抑制探针置换扩增(BDA)原理实现的。Blocker抑制能力越强,荧光信号起峰的时间就会越晚。通过热动力学参数可以精确调节扩增曲线的相对关系,并且无Blocker扩增子的Ct值可以作为定量结果(图 2)。

图2 CCM的实现方法
针对样本中可能存在多个靶标的问题,双管、双扩增曲线(T=2)的CCMA策略可以区分任意单一或成对靶标。以血流感染(BSI)为例,其中约 89.3% 的病例为单一感染源,复合感染以两种致病菌的情况居多,双管CCMA检测可以覆盖约98.6%的病例。
多重扩增
超多重qPCR的另一个难点来自于引物二聚体和非特异性扩增的干扰。为了弥补单条引物浓度下降带来的扩增效率降低,多重扩增体系通常会增加循环数和退火延伸时间,这也加剧了二聚体甚至多聚体的形成。
目前主流的抑制二聚体的思路包括1)设计具有特殊结构的引物;2)使用UDG酶、Cas9或基于片段大小的纯化方法去除二聚体;3)利用算法优化引物设计。前两种策略一定程度增加了试剂成本或产物损失。第三种策略则对引物设计有着更严格的要求,然而主流算法中很少专门针对引物二聚体进行深度优化。阅尔基因联合上海肺科医院开发的二聚体似然估计的模拟退火设计(SADDLE)算法,能够进行多重PCR引物的全自动化设计和迭代优化,在大型panel中实现了超低的引物二聚体水平⁶。验证实验显示,384-plex panel(768条引物)的引物二聚体比例仅为1%。

图3 SADDLE算法的基本流程
借助SADDLE算法设计21联病原体检测试剂盒(63-plex panel)并对PCR产物进行NGS分析,证明了CCMA体系极低的脱靶率和引物二聚体水平。即使在高浓度人源gDNA干扰的情况下,目标扩增子的reads 占比也明显高于脱靶扩增 reads。进一步,将病原体检测panel与168-plex非病原微生物panel混合后,CCMA的检测结果依然不受影响,并且没有出现非特异性扩增(假阳性)的情况。这证明了CCMA具备模块化设计的能力,SADDLE算法的正交优化能力降低了不同体系设计中引物互作的风险。

图4 基于CCM检测21种病原体的qPCR panel设计
起始量在5~1800拷贝之间时,63-plex panel检测各个靶标DNA的相邻扩增曲线之间的Ct 延迟(ΔCt)中位值分别为 2.30 和 3.65,并且始终不低于0.9,证明CCMA良好的扩增稳定性。理论上,BDA探针可以实现小于3且可复现的ΔCt,从而允许设置更多编码组合,比如两通道体系将Ct延迟数(T)从2增加到3时可以将编码组合从4种提高到6种。另一方面,反应速率可调性也为平衡各个扩增子之间的PCR效率提供了较为直接的途径。
最低检测限(LoD)方面,在30 拷贝及以上水平,CCMA 成功检出所有21个病原体的DNA模拟样本,并且其中12个病原体(如李斯特菌)的LoD低至5拷贝。
定量准确性方面,以100拷贝起始量对21种病原体进行三次重复定量,中位标准差分别为0.18、0.25 和 0.31。回归分析显示标准曲线的决定系数(R2)在0.994 至 0.999 之间。此外,不同试剂批次、操作人员和时间点的重复实验证明了CCMA的定量可重复性,首位Ct值的标准差为0.25,相当于不到20%的起始量变化。
总之,CCMA多重荧光定量体系的主要特点可以总结如下:
·以BDA原理为基础的可编程荧光编码系统,实现了超指数级多重PCR
·SADDLE算法降低了引物二聚体的产生,保证了扩增体系的稳定性和特异性
·使用常规qPCR仪进行检测,引物探针的类型和修饰与常规Taqman 荧光定量法一致
·LoD和定量能力与常规qPCR一致,可检测低至5~30拷贝的靶标分子
·最低仅需200uL全血即可一次排查21种常见病原菌
·可以容忍模板序列上一定程度的单碱基多态性
·耐受模板中高浓度的宿主核酸
除了成本和速度上的优势以外,超多重性将为qPCR检测方案拓展更广阔的应用前景。特别地,超多重qPCR的可定量性对于临床端的价值不容忽视,尤其在病原检测方面,可以帮助医生判断感染程度以及感染源的主次关系。CCMA技术在呼吸道疾病、血流感染等领域已经初步展现出临床应用价值,集成化且模块化的设计流程以及灵活的体系优化方式为开发更多高可用性的超多重qPCR病原检测产品提供了平台。
参考文献
1. Chen, W. et al. Advancing quantitative PCR with color cycle multiplex amplification. Nucleic Acids Res (2024) doi:https://doi.org/10.1093/nar/gkae683.
2. Xie, N. G. et al. High-Throughput Variant Detection Using a Color-Mixing Strategy. J Mol Diagn 24, 878–892 (2022).
3. Santos-Barriopedro, I., Sylvain Ursuegui, Etienne Fradet & Rémi Dangla. Robust higher-order multiplexing in digital PCR by color-combination. bioRxiv (2023) doi:https://doi.org/10.1101/2023.05.10.540190.
4. Huang, Q. et al. Highly multiplex PCR assays by coupling the 5′-flap endonuclease activity of Taq DNA polymerase and molecular beacon reporters. Proc Natl Acad Sci 119, (2022).
5. Joon Soo Park, Pisanic, T., Zhang, Y. & Wang, T.-H. Ligation-Enabled Fluorescence-Coding PCR for High-Dimensional Fluorescence-Based Nucleic Acid Detection. Anal Chem 93, 2351–2358 (2021).
6. Xie, N. G. et al. Designing highly multiplex PCR primer sets with Simulated Annealing Design using Dimer Likelihood Estimation (SADDLE). Nat Commun 13, (2022).
关于阅尔基因
阅尔基因是一家技术创新驱动的全球基因组学公司,拥有多项革命性的分子检测技术,可将所有NGS平台的测序成本降低98%以上,并将qPCR、Sanger和纳米孔测序的灵敏度提高100倍以上。
阅尔基因在美国休斯顿、中国上海、中国苏州和中国启东均设有分部,旗下拥有CAP/CLIA双认证医检所以及符合国际标准的GMP生产车间。阅尔基因的愿景是创造负担得起的、及时的和准确的基因分析工具,与诸多合作伙伴一起实现精准医疗并改善患者预后。